


แบบจำลองอะตอมกลุ่มหมอก
แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติมทางกลศาสตร์ควอนตัม แล้วสร้างสมการสำหรับใช้คำนวณ โอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่าง ๆ ขึ้นมา จนได้แบบจำลองใหม่ ที่เรียกว่าแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีรายละเอียดดังนี้
อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็ว ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่าง ๆ ปรากฏการณ์แบบนี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่นจะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงาน จะเป็นรูปดังภาพ

การจัดเรียงอิเล็กตรอนในอะตอม
1. จัดเรียงอิเล็กตรอนในระดับพลังงานหลัก (Shell)
2.จัดเรียงอิเล็กตรอนในระดับพลังงานย่อย (Sub Shell)
3.จัดเรียงอิเล็กตรอนในออร์บิทัล (Orbital)
1. การจัดเรียงอิเล็กตรอนในระดับพลังงานหลัก
จำนวนอิเล็กตรอนในแต่ละระดับพลังงานหลักมีจำนวนไม่เกิน 2n2
เมื่อ n คือระดับพลังงานหลักที่ 1 , 2 , 3 , . . .
ระดับพลังงานหลัก n=1 มีอิเล็กตรอนไม่เกิน 2 อิเล็กตรอน
ระดับพลังงานหลัก n=2 มีอิเล็กตรอนไม่เกิน 8 อิเล็กตรอน
ระดับพลังงานหลัก n=3 มีอิเล็กตรอนไม่เกิน 18 อิเล็กตรอน
ระดับพลังงานหลัก n=4 มีอิเล็กตรอนไม่เกิน 32 อิเล็กตรอน
ตามความสัมพันธ์นี้การจัดเรียงอิเล็กตรอนในแต่ละระดับพลังงาน จะมีอิเล็กตรอนได้ไม่เกินจำนวนสูงสุดที่จะมีได้ ถ้าพิจารณา K และ Ca ซึ่งควรมีอิเล็กตรอนเป็น 2 , 8 , 9 และ 2 , 8 , 10 เนื่องจากในระดับพลังงานที่ 3 มีได้ถึง 18 อิเล็กตรอน แต่จากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของ K = 2 , 8 , 8 , 1 และ Ca = 2 , 8 , 8 , 2 เนื่องจากอิเล็กตรอนในระดับพลังงานที่ 3 ของทั้งสองธาตุมีเพียง 8 อิเล็กตรอน และส่วนที่เพิ่มขึ้นมาอีก 1 หรือ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 เพราะการจัดเรียงอิเล็กตรอน อิเล็กตรอนชั้นนอกสุดซึ่งเรียกว่าเวเลนซ์อิเล็กตรอนต้องไม่เกิน 8


2. การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
จากการศึกษาสมบัติที่เป็นคลื่นของอิเล็กตรอน พบว่าอิเล็กตรอนอยู่ในระดับพลังงานหรือวง (shell) ต่าง ๆ กัน ซึ่งเรียกว่าระดับพลังงานหลัก และในระดับพลังงานเดียวกันยังมีระดับพลังงานย่อย (sub shell) ต่าง ๆ อีก คือระดับพลังงานย่อย s , p , d และ f โดยในแต่ละระดับพลังงานย่อยมีอิเล็กตรอนดังนี้
ระดับพลังงานหลักที่ 1 (n=1) มี 1 ระดับพลังงานย่อยคือ s
ระดับพลังงานหลักที่ 2 (n=2) มี 2 ระดับพลังงานย่อยคือ s , p
ระดับพลังงานหลักที่ 3 (n=3) มี 3 ระดับพลังงานย่อยคือ s , p , d
ระดับพลังงานหลักที่ 4 (n=4) มี 4 ระดับพลังงานย่อยคือ s , p , d , f
อิเล็กตรอนมีการเคลื่อนที่อยู่ตลอดเวลา ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนซึ่งวัดออกมาในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งเคลื่อนที่รอบนิวเคลียสจะมีรูปร่างเป็น 3 มิติที่แตกต่างกันซึ่งเรียกว่า ออร์บิทัล

ออร์บิทัล (orbital)
หมายถึงบริเวณที่มีโอกาสสูงที่จะพบอิเล็กตรอน หรือบริเวณที่อยู่ของอิเล็กตรอน ซึ่งมีรูปร่างเป็น 3 มิติแตกต่างกัน ดังนี้
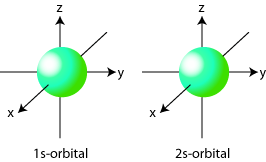


s–orbital มีความหนาแน่นของอิเล็กตรอนรอบนิวเคลียสเ�ท่ากันทุกทิศทาง ทำให้มองเห็นว่าออร์บิทัลนี้มีรูปร่างเป็นทรงกลมรอบนิวเคลียส
p–orbital มีความหนาแน่นของอิเล็กตรอนรอบนิวเคลียสอยู่ในบริเวณแกน x , y , z จึงเป็น px–orbital , py–orbital , pz–orbital ตามลำดับ โดยออร์บิทัลทั้งสามมีรูปร่างคล้ายดรัมเบลล์ มีพลังงานเท่ากัน แต่มีทิศทางแตกต่างกัน
d–orbital มีความซับซ้อนมากยิ่งขึ้น โดยสองออร์บทัลคือ และ มีความหนาแน่นของอิเล็กตรอนรอบนิวเคลียสอยู่ในบริเวณแกน z และแกน x กับแกน y ตามลำดับ ส่วนอีกสามออร์บิทัลคือ , และ ความหนาแน่นของอิเล็กตรอนจะอยู่ในบริเวณระหว่างแกน x กับ y แกน y กับ z และแกน x กับ z ตามลำดับ
ระดับพลังงานย่อย
s จำนวนออร์บิทัล 1 จำนวนอิเล็กตรอนแต่ละออร์บิทัล 2 จำนวนอิเล็กตรอนรวม 2
p จำนวนออร์บิทัล 3 จำนวนอิเล็กตรอนแต่ละออร์บิทัล 2 จำนวนอิเล็กตรอนรวม 6
d จำนวนออร์บิทัล 5 จำนวนอิเล็กตรอนแต่ละออร์บิทัล 2 จำนวนอิเล็กตรอนรวม 10
f จำนวนออร์บิทัล 7 จำนวนอิเล็กตรอนแต่ละออร์บิทัล 2 จำนวนอิเล็กตรอนรวม 14


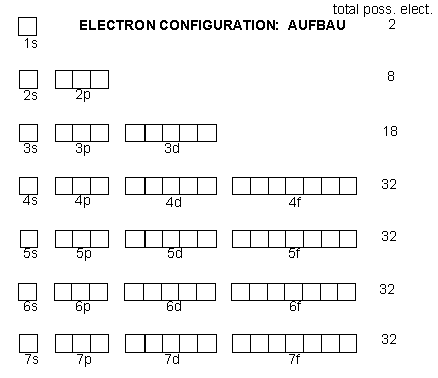
3. การจัดเรียงอิเล็กตรอนในออร์บิทัล
1. ใช้หลักการกัดกันของเพาลีที่กล่าวว่า อิเล็กตรอนคู่หนึ่งคู่ใดในออร์บิทัลเดียวกันจะต้องมีสมบัติไม่เหมือนกัน อย่างน้อยต้องมีการหมุนรอบตัวเองไม่เหมือนกัน โดยตัวหนึ่งหมุนตามเข็มนาฬิกา และอีกตัวหนึ่งหมุนทวนเข็มนาฬิกา เพื่อให้ระบุได้ว่าเป็นอิเล็กตรอนตัวใดเมื่ออิเล็กตรอนอยู่ในระดับพลังงาน ระดับพลังงานย่อย และในออร์บิทัลเดียวกัน จึงกำหนดให้บรรจุอิเล็กตรอนลงในออร์บิทัลได้สูงสุด 2 อิเล็กตรอน ให้ แทนออร์บิทัล อิเล็กตรอนเขียนด้วยลูกศร อิเล็กตรอนในออร์บิทัลจึงเขียนแทนได้เป็น หรือ โดยหัวลูกศรแสดงทิศทางการหมุนของอิเล็กตรอน 1 ใน 2 แบบที่เป็นไปได้ ในกรณีที่มีอิเล็กตรอนเต็มออร์บิทัลสามารถเขียนเป็น ถ้าเขียนเป็น หรือ จะไม่สอดคล้องตามหลักการกีดกันของเพาลี
2. การบรรจุอิเล็กตรอนต้องบรรจุลงในออร์บิทัลที่มีพลังงานต่ำสุดและว่างก่อนเสมอ (ตามหลักของเอาฟบาว) คือ 1s 2s 2p 3s . . . ตามลำดับ เพราะจะทำให้พลังงานรวมทั้งหมดมีค่าต่ำสุดและมีความเสถียรที่สุด ในกรณีที่มีหลายออร์บิทัลและแต่ละออร์บิทัลมีพลังงานเท่ากัน เช่น 2p–orbital ซึ่งออร์บิทัลทั้งสามมีพลังงานเท่ากัน ให้บรรจุอิเล็กตรอนในลักษณะที่ทำให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้ (ตามกฎของฮุนด์) เมื่ออิเล็กตรอนเหลือจึงบรรจุอิเล็กตรอนเป็นคู่เต็มออร์บิทัลนั้น เช่น
¢ มี 2 อิเล็ตรอนใน 2p–orbital จะบรรจุอิเล็กตรอนได้เป็น
¢ มี 5 อิเล็ตรอนใน 2p–orbital จะบรรจุอิเล็กตรอนได้เป็น
3. อะตอมของธาตุที่มีการบรรจุอิเล็กตรอนเต็มในทุก ๆ ออร์บิทัลที่มีพลังงานเท่ากันเรียกว่า การบรรจุเต็ม (full filled) ถ้ามีอิเล็กตรอนบรรจุอยู่เพียงครึ่งเดียวเรียกว่า การบรรจุครึ่ง (half filled) การบรรจุเต็มหรือบรรจุครึ่งจะทำให้อะตอมมีความเสถียรมากกว่าการบรรจุแบบอื่น ๆ
การบรรจุเต็ม
การบรรจุครึ่ง
ในกรณีที่มีหลายอิเล็กตรอน การบรรจุอิเล็กตรอนลงในออร์บิทัลต่าง ๆ ตามลำดับพลังงานจากต่ำไปสูงจะเป็นดังนี้
การจัดเรียงอิเล็กตรอนเข้าในระดับพลังงานตามลำดับ


อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน (valence electron)
การบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ ตามลำดับระดับพลังงาน มีบางธาตุที่มีการบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่เป็นไปตามหลักการ เช่น Cr เลขอะตอม 24 มีแผนภาพแสดงการจัดเรียงอิเล็กตรอนในออร์บิทัลต่างๆ ดังนี้
Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5 ไม่ใช่ 4s2 3d4
Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10 ไม่ใช่ 4s2 3d9

The Prince Royal's College
117 ถนนเเก้วนวรัฐ ต.วัดเกต อ.เมือง จ.เชียงใหม่ 50000
โทร. 05324-2038
เว็บ www.prc.ac.th


